Гальванотехника. Электролиз. Постоянный ток в электролитах.
treugoma.ru › Учебник › Химическое действие тока. Источники постоянного тока ›
Гальванотехника. Электролиз. Постоянный ток в электролитах.
Молекулы растворителя под действием растворителя распадаются на положительные и отрицательные ионы. Ионы водорода или металла имеют положительный заряд, а неметаллический остаток молекулы электролита – отрицательный.
Так, под действием растворителя (например, воды) молекула поваренной соли (NaCl) распадается на положительный ион натрия (Na+) и отрицательный ион хлора (Cl-); молекула медного купороса (CuSO4) – на положительный ион меди (Cu+) и отрицательный ион сульфита (SO4 -) и т.д.
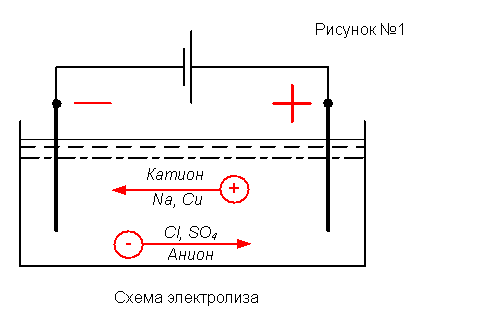
Если в электролит опустить два электрода (рисунок №1) и приложить к ним напряжение, то под действием электрического поля к отрицательному электроду – катоду – будут перемещаться положительные ионы, которые называют катионами, а к положительному электроду – аноду – отрицательные ионы, которые называют анионами. Достигая электрода, ионы отдают ему свой заряд и либо вступают с ним в химическую реакцию, либо, оседают на нем.
Процесс выделения вещества электролита на электродах называется электролизом.
Электролиз широко применяют в технике для получения металлов и их соединений, отдельных металлов от примесей, нанесения металлических покрытий, на металлические предметы и изготовления металлических копий с неметаллических предметов (гальванотехника).
Гальванотехника открыта русским ученым Б. С. Якоби в 1840 г. Она делится на гальванопластику – получение легко отделяющихся металлических точных копий с различных предметов и изготовления металлических копий с различных предметов и гальваностегию – нанесение на изделие из металла тонких покрытий из других металлов, например неподдающихся коррозии.
Для нанесения металлического покрытия изделия (катод) соединяют с отрицательным полюсом источника энергии и погружают в электролит, содержащий положительные ионы осаждающегося металла. Анодом служат пластины или прутки из толстого металла, которым покрывают изделие. В некоторых случаях используют и нерастворимые аноды. Тогда на изделии (положительный полюс источника) выделяют атомы кислорода, окисляющие поверхность металлического изделия. Напряжение а электродах составляет 6….12 В, плотность тока 1…10 А на 1 дм2 , поверхность покрываемой детали.
Изделие предварительно отчищают от ржавчины, окалины, смазок, жиров и пр., подвергая его механической очистке (шлифовке, полировке и т.д.), электрохимическому обезжириванию (в щелочном электролите), травлению (в щелочных или кислотных электролитах).
К наиболее распространенным операциям по металлическому покрытию относятся цинкование, кадмирование, лужение, свинцование, меднение, никелирование, хромирование, серебрение, золочение, оксидирование.
