Химические источники тока. Гальванические элементы.
treugoma.ru › Учебник › Химическое действие тока. Источники постоянного тока ›
Химические источники тока. Гальванические элементы.
К химическим источникам тока, в которых происходит прямое преобразование химическое энергии в электрическую, относятся гальванические элементы, аккумуляторы, а также комбинированные источники тока типа топливный элемент – аккумулятор. Эти источники тока, как правило имеют высокий к.п.д., работают бесшумно, практически не загрязняют окружающую среду.
Гальванические элементы – это первичные химические источники тока, в которых химические реакции необратимы. В простейшем виде, элемент представляет собой два электрода из разных металлов, погруженных в раствор электролита. При этом на одном из электродов (катоде) идет реакция растворения материала электрода или окисления, при которой электрод теряет электроны, отдавая их во внешнюю электрическую цепь. На другом электроде (аноде) идет реакция восстановления – нейтрализация ионов материала, окружающего электрод, за счет электронов, поступающих с катода по внешней цепи. Разность потенциалов (электродвижущая сила) для различных элементов находится в пределах от 0,85 до 3 В.
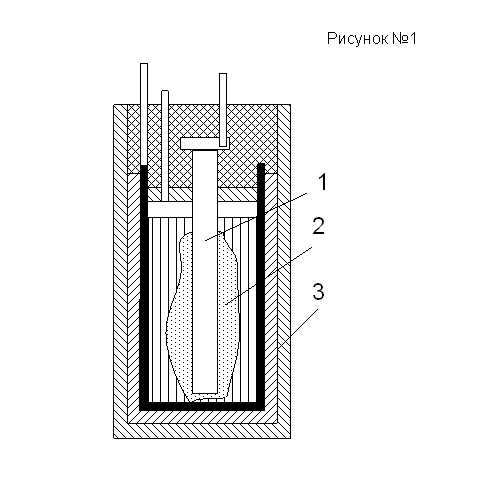
Наиболее широко применяемых гальванических элементах (для питания радиоприемников, сотовых телефонов и т.д.) положительный электрод представляет собой угольный стержень 1 (рисунок №1) и массу 2 из активного угля или смеси двуокиси марганца с графитом, а отрицательный – цинковую обкладку 3 в виде стаканчика или чашечки. В качестве электролита чаше всего используется раствор нашатыря.
Галетному элементу (рисунок №2)придана плоская форма, удобная для соединения в батарею. На наружную сторону цинкового электрода 4 нанесен специальный электропроводящий слой, не пропускающий электролит. Собранный элемент покрывают тонкой хлоровидной пленкой 5. Такое устройство имеет, например, батарея “Крона” или “Таблетка”.
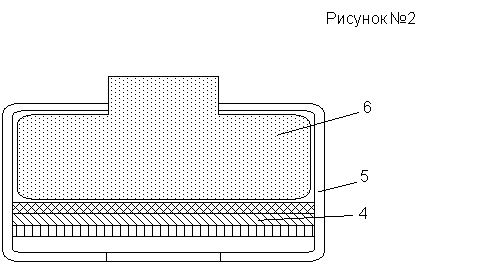
Пленочное покрытие изолирует отдельные элементы с боков, препятствует вытеканию электролита, но легко пропускает газы, образующиеся внутри элемента. Масса из активного угля 6 несколько выступает из галеты для удобного контакта с другой галетой. В этих батареях активный материал используется лучше и полнее, чем у стаканчиковых батарей.
Сухие гальванические элементы поступают в готовом виде, водоналивные перед употреблением необходимо залить водой.
Напряжение гальванического элемента, всегда меньше, чем развиваемая им э.д.с., во-первых, вследствие падения напряжения внутри элемента на его внутреннем сопротивлении, во-вторых, из-за явления поляризации электродов под влияние проходящего в цепи тока. Например выделение водорода на катоде и кислорода на аноде сопровождается возникновением потенциалов поляризации, которые направлены навстречу электродным потенциалам и снижают их. Чтобы уменьшить влияние поляризации на работу элемента, применяют деполяризаторы – вещества, которые принимают на себя водород или кислород, вступают с ними в реакцию и таким образом способствуют снижению потенциала поляризации. В гальванических элементах с угольным электродом в качестве деполяризатора используется двуокись марганца.
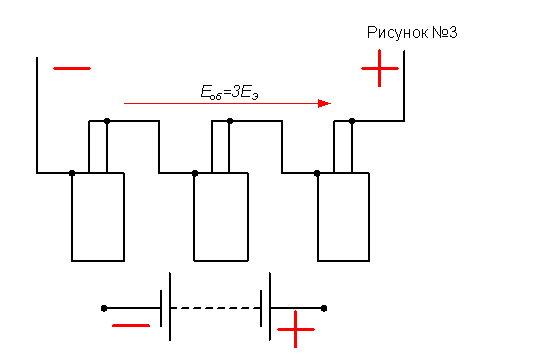
Чтобы в электрической цепи получить напряжение, превышающее напряжении одного элемента, элементы соединяют в батарею, включая их последовательно, то есть положительный полюс каждого предыдущего элемента соединяют с отрицательным полюсом последующего (рисунок №3). Общая электродвижущая сила батареи в этом случае равна сумме электродвижущих сил отдельных элементов:
![]() (1)
(1)
Когда элементы одинаковы и их э.д.с. равны батареи, состоящей из n элементов,
![]() (2)
(2)
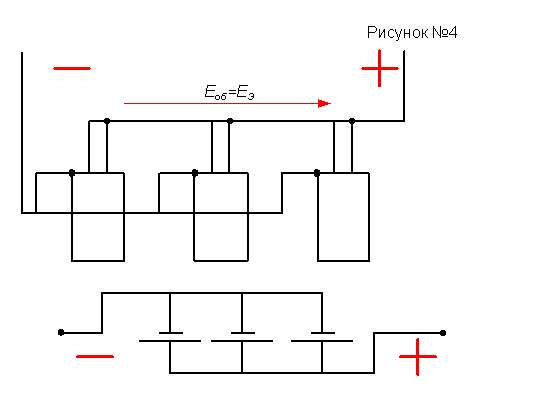
Если по условиям работы в цепи требуется небольшое напряжение, а ток нагрузки – превышающий ток разрядки одного элемента, используют батарею из параллельно включенных элементов (рисунок №4), в которой все полюсы одинаковых полярностей соединены между собой. В этом случае э.д.с. всей батареи равна э.д.с. одного из элементов, а разряд увеличивается в n раз, где n- число элементов в батарее.
Цифры в маркировке батарей означают следующее: первые – начальное напряжение батареи в вольтах, последние – начальный электрический заряд батареи в ампер – часах или продолжительность ее работы в часах, если за последней цифрой стоит буква “ч”. Первые буквы расшифровывают так: А – анодная, Н – накальная, Ф – фонарная, Т – телефонная, П- приборная, АН – анодно – накальная, АС – анодно – сеточная, СА – слуховой анод, ЭВ – для электронной вспышки, АА- алкалиновая и т.д. Буквы МЦ – свидетельствуют о том, что батарея угольно – марганцево – цинковая, далее Г – галетная, Ч – чашечковая. Отсутствие буквы после МЦ указывает на то, что батарея стаканчиновая. Буквами Х и У обозначают соответственно хладостойкую (в зависимости от состава электролита) батарею. Летние батареи отличительной буквы не имеют.
Для питания транзисторных приборов применяют окиснортутные (ОР) гальванические элементы миниатюрных размеров.
Гальванические элементы необходимо защищать от коротких замыканий и не рекомендуется проверять “на искру”. Напряжение их следует измерять под нагрузкой. При отсутствии нагрузки вольтметр покажет э.д.с. , которая не характеризует степени использования батареи.
